1 m3 de aire a 27 °C y 1
atm se comprime hasta un volumen de 5 litros a temperatura constante. Calcular
la presión final empleando la ecuación de Van der Waals.
Las constantes experimentales de la
ecuación de Van der Waals para el aire son:
a=1,33
atm(l/mol)2
b=
0.0366 l/mol
DATOS
V1=
1m3
T1=
27°C = 300.15 K
P1=1atm
V2= 5L
T2= 27°C = 300.15 K
P2 =
?
1.- Se determina el
número de moles
Como
la presión inicial es baja, el número de moles se puede calcular con la
ecuación universal de los gases ideales.
2.- Se cálcula la presión
con la ecuación de Van der Waals con las condiciones finales
Calcule la presión
ejercida por 5 moles de CH3OH gaseoso que
ocupa el volumen de V = 0,6187 litros, a una temperatura de 500K usando la ecuación universal de los gases y la ecuación de Van der Waals
y comparar los resultados. Determinar el % de error entre ambos valores.
Estos valores de presión y temperatura se encuentran por debajo de la
temperatura crítica del metanol
(Tc = 512,5 K, Pc = 80,8 atm)
y las constantes experimentales de la ecuación de Van der Waals para el metanol
son:
a = 9,23×106 cm6 atm mol-2
b = 65,1 cm3 mol-1
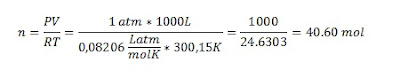

¿Y la respuesta de el segundo problema?
ResponderEliminaralguien con la solución
ResponderEliminarde este ultimo problema
Alguien me puede ayudar con unos ejercicios que son de práctica para química ?
ResponderEliminarCalcule la presión ejercida por 5 moles de CH3OH gaseoso que ocupa el volumen de V = 0,6187 litros, a una temperatura de 500K usando la ecuación universal de los gases y la ecuación de Van der Waals y comparar los resultados. Determinar el % de error entre ambos valores.Estos valores de presión y temperatura se encuentran por debajo de la temperatura crítica del metanol(Tc = 512,5 K, Pc = 80,8 atm) y las constantes experimentales de la ecuación de Van der Waals para el metanol son:
ResponderEliminara = 9,23×106 cm6 atm mol-2
b = 65,1 cm3 mol-1 Quien me ayuda con esa actividad, por favor
muy buena explicación, ayudo mucho a entender el tema.
ResponderEliminar